MATERIEL et VERRERIE
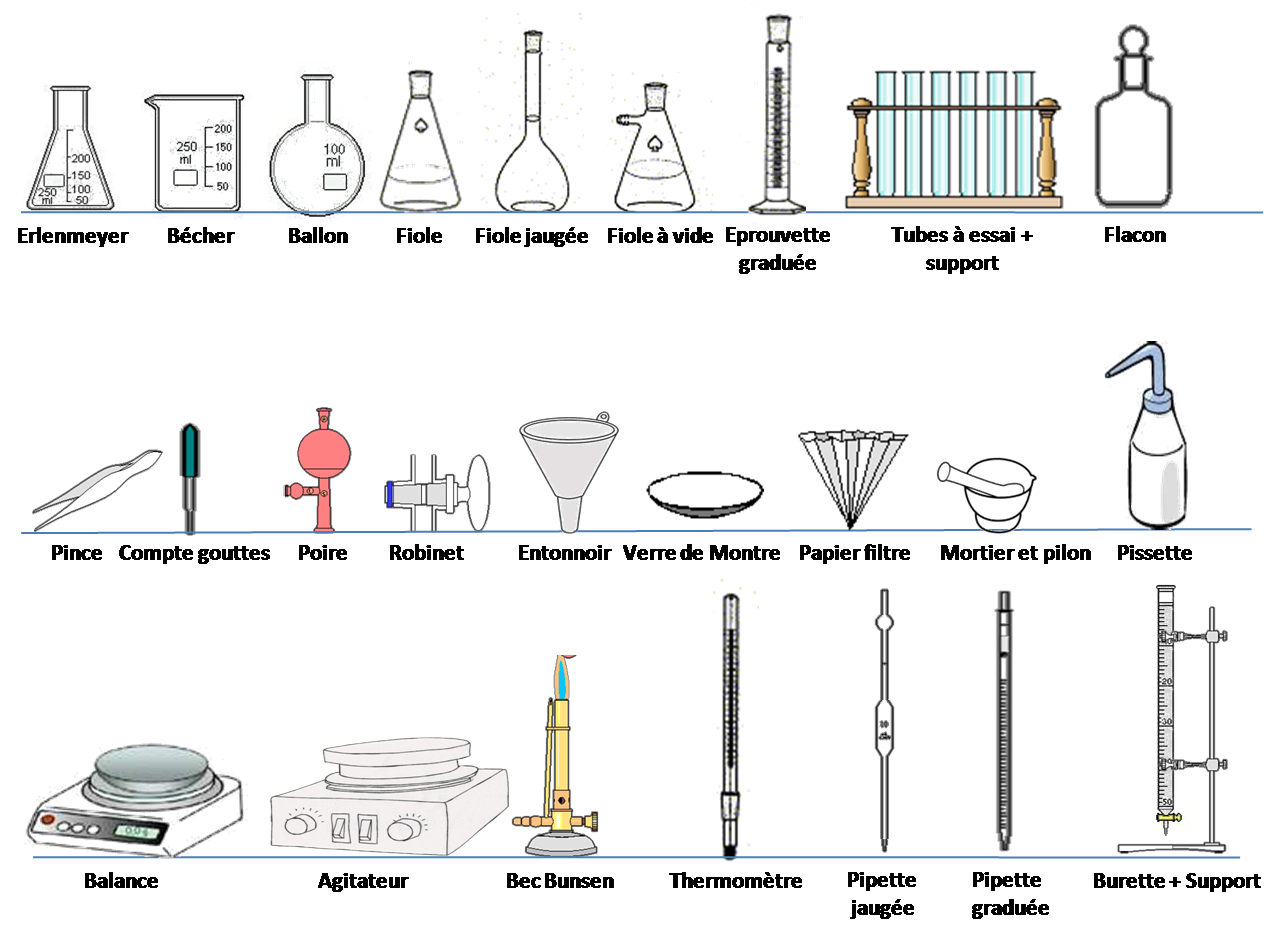
Tous les laboratoires de chimie partagent principalement en commun les équipements de laboratoire, la verrerie et les appareils de caractérisation. Une hotte de laboratoire est indispensable où des produits chimiques toxiques et dangereux peuvent être manipulés sans risque, un évier pour se laver les mains et la verrerie, il y a habituellement un magasin où les produits chimiques secs et humides sont stockés d'où on distribue la verrerie, le petit matériel et les équipements de protection. L'équipement de laboratoire désigne les divers outils et ustensiles utilisés par les scientifiques qui travaillent en laboratoire. Cela comprend : - Des appareils comme l’agitateur, les spectrophotomètres et les calorimètres…etc. ;
- Une verrerie d’usage général comme le bécher, les tubes à essai, et l’erlenmeyer ;
- Une verrerie volumétrique comme les pipettes (graduée, jaugée) et la burette ;
- Verrerie spécifique (distillation, chauffage…) comme les ballons (bicol, tricol), réfrigérant, …et
- Accessoires comme la pissette, l’entonnoir, le papier filtre…etc.
L'équipement du laboratoire est en général utilisé, soit pour réaliser une manipulation, ou expérience, soit pour effectuer des mesures et rassembler des données. Il faut adapter le volume de la verrerie utilisée à la manipulation:
- Fiole ou pipette jaugée pour une mesure très précise
- Eprouvette ou pipette graduée pour une mesure précise
- Bécher, erlenmeyer…pour une mesure peu précise
MODE D’EMPLOI DE CERTAINS USTENSILES
La pipette
Le pipetage à la bouche est strictement interdit en raison du risque d'avaler un solvant toxique ou corrosif. On utilise donc une propipette qui se place à l'extrémité de la pipette.
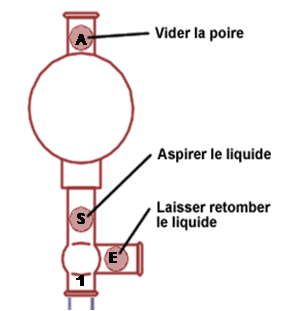
Afin de créer l'aspiration qui va permettre de prélever le liquide : - Presser la poire en pressant sur la valve "A".
- Enfoncer légèrement l'embout de la pipette dans la propipette dans l'orifice prévu à cet effet (noté 1 sur le schéma).
- Immerger la pipette dans la solution et aspirer le liquide en appuyant sur la valve "S".
- Vider le liquide dans le bécher en appuyant sur la vanne "E". Afin que le liquide ne se déverse pas trop rapidement, faire un angle de 45° entre le bécher et la pipette en plaçant la pointe de celle-ci contre la paroi du bécher tout en la gardant bien verticale.
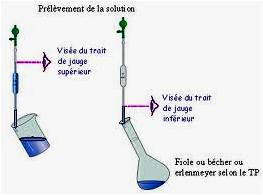
La lecture : au trait doit s'effectuer à hauteur des yeux. Nettoyage : il faut veiller à ne pas introduire de liquide à l'intérieur de la poire. Si par accident, du liquide rentre à l'intérieur, bien rincer avec de l'eau et sécher au mieux avec du papier absorbant.
Précision des pipettes jaugées : La précision de la pipette est un critère important d'achat et d'utilisation. Pour les dosages, seules les "jaugées" peuvent être utilisées, les pipettes graduées n'étant pas assez précises. La burette
Une burette est un tube en verre gradué et étalonné muni d'un robinet servant à verser lentement le réactif lors d'un dosage. Elle existe sous plusieurs formats : 25 mL et 50 mL étant les plus courants. Les graduations sont en général précises à 0,05 mL mais peuvent également être de 0,1 mL.
Mode d'emploi :
- Verser une petite quantité de réactif dans la burette afin de la rincer.
- Après rinçage, la remplir entièrement et ouvrir le robinet pour éliminer les éventuelles bulles d'air coincées au niveau du robinet.
- La remplir à nouveau et faire le zéro en vidant lentement le surplus de solution titrante.
- Lors du dosage, verser des volumes par palier de 1 mL en resserrant les volumes au niveau du point équivalent jusqu'à faire un goutte à goutte pour avoir une précision suffisante.
- Après dosage, vider entièrement la burette et rincer avec de l'eau distillée. Lorsque la burette reste inutilisée, la remplir d'eau distillée.
Lecture : On effectue la lecture de volume au bas du ménisque en maintenant l'œil face à la graduation pour éviter l'erreur de parallaxe (voir A & C). Le bas du ménisque doit coïncider avec la graduation. L'œil est face à la graduation pendant la lecture (voir B). 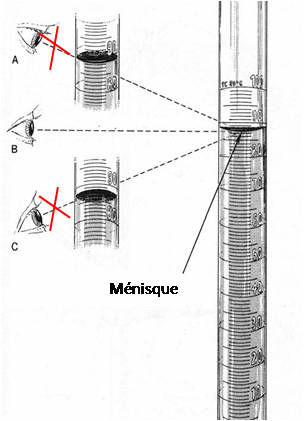
Maintenance : le robinet peut être en verre ou en Téflon. Pour celle ayant un robinet en verre, il est conseillé de graisser celui ci avec une graisse silicone (utilisée pour les rodages par exemple) de temps en temps afin d'éliminer tout risque de grippage.
NOTIONS DE BASE
Solvant : Un solvant est un liquide qui a la propriété de dissoudre et de diluer d’autres substances sans les modifier chimiquement et sans lui-même se modifier. Ils permettent de dissoudre les réactifs et d’amener les réactifs en contact, sans réagir chimiquement avec eux (on dit qu’ils sont inertes).
Pour les solutions liquides, si l’une des espèces est largement majoritaire (au moins un facteur 100), on l’appelle solvant. C’est le cas de l’eau pour les solutions aqueuses.
Soluté : Substance dissoute dans un solvant
Réactif : Lors d’une réaction chimique, un réactif est une espèce chimique présente dans le système réactionnel qui tend à diminuer au cours du temps : les réactifs sont consommés. Les atomes se réarrangent pour former de nouvelles molécules : les produits de cette réaction.
Masse moléculaire : La masse moléculaire est le rapport entre la masse d’une molécule et l’unité de masse des atomes (uma, équivalente à 1/12 de la masse d’un atome de carbone 12). La masse molaire est équivalente à autant de g qu’il y a d’unités dans la masse moléculaire.
Masse molaire : La masse molaire est la masse d’une mole d’un composé chimique exprimée en grammes par mole (g.mol-1 ou g/mol).
n = m / M n : nombre de moles (mol) m : masse (g) M : masse molaire (g/mol)
Masse volumique : Pour toute substance homogène, le rapport de la masse m correspondant à un volume V de cette substance: c'est une caractéristique du matériau appelée masse volumique: ρ = m/V
Normalité : le nombre d’équivalents grammes de soluté par litre de solution (éq.g/l), on se sert toujours de la règle suivante:
N1V1 = N2V2
où N1 ,V1 sont la normalité et le volume de la solution
N2,V2 ceux de la solution à titrer
Densité : La densité est un nombre sans dimension, égal au rapport d'une masse d'une substance homogène à la masse du même volume d'eau pure à la température de 3,98 °C. Par définition, la densité de l'eau pure à 3,98 °C est égale à 1. La définition de la densité permet sa mesure en laboratoire. Elle peut aussi se calculer en divisant la masse volumique de la substance par 1000 kg/m3, masse volumique de l'eau pure à 3,98 °C : d = ρ/1000
Concentration massique : La concentration massique d'une solution est la masse de soluté que l'on a dissous pour obtenir un litre de solution : C (g.l-1) = m (g) / v (l)
Concentration molaire : La concentration molaire d'une solution est la quantité de matière (= nombre de moles) de soluté que l'on a dissous pour obtenir un litre de solution. C (mol.l-1) = n (mol) / v(l)
pH : En chimie, le pH mesure l'activité de protons (H+) solvates. Le pH mesure l'acidité ou la basicité d'une solution. On dit solution acide (pH< 7), et une solution basique (pH>7).
Indicateur coloré : pour déceler le point d’équivalence dans un titrage, on emploie les indicateurs colorés dont les couleurs varient en fonction du pH de la solution. Exp : la phénolphtaléine est incolore en milieu acide mais de couleur rose.
Dissolution : Mise en solution
Dilution : Adjonction de solvant à une solution pour en diminuer la concentration
Exercices (calculs de : N°11 La masse molaire, N°29 Concetratioin d'une solution) VIDEO A PROPOS DE CE SUJET
http://www.ccdmd.qc.ca/ri/gestesdelascience/ (clic sur Vidéos---->Chimie)