Le dosage acido-basique est utilisé afin de déterminer la concentration inconnue d'une solution composée d'un acide ou d'une base, ou d'un mélange. Si la solution de titre inconnu est un acide, on verse une base de façon à neutraliser l'acide, l'intérêt étant de déterminer précisément la quantité de base ajoutée pour neutraliser l'acide. Il existe deux méthodes :
- l'utilisation d'un indicateur coloré (volumétrie colorimétrique non-instrumentale),
- le tracé de la courbe qui donne le pH en fonction du volume de base ajouté (volumétrie instrumentale).
But du TP L’objectif de cette manipulation est de savoir réaliser un dosage acido-basique simple. Il y sera effectué la détermination par dosage de la normalité, la molarité et la concentration pondérale d’une solution de NaOH inconnue. La réalisation de cette expérience nécessite la maîtrise de calcul en volumétrie.
Principe Le titrage (dosage) acido-basique est une méthode volumétrique pour la détermination de la normalité inconnue de la base en utilisant la normalité connue de l’acide et inversement.
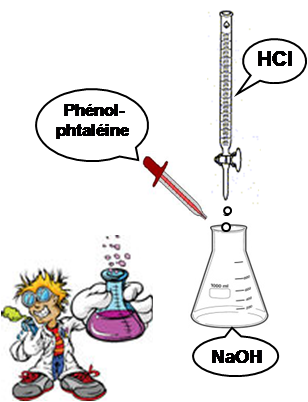
Mode opératoire - Avec une pipette propre bien rincée avec la solution NaOH préparée, prendre 10 ml de NaOH et verser la dans un erlenmeyer bien propre.
- Ajouter 2 à 3 gouttes d'indicateur coloré (phénolphtaléine).
- Rincer puis remplir la burette avec la solution d'acide chlorhydrique (HCl) préparée.
- Poser l’erlenmeyer sur une feuille blanche au dessous de la burette.
- Commencer le titrage en ouvrant le robinet de la burette doucement, tout en agitant la solution de NaOH au moyen de mouvements circulaires.
- Titrer le NaOH jusqu’au point d’équivalence (fermeture du robinet). La solution devient transparente (auparavant elle était rose).
- Noter le volume d’HCL versé.
- Refaire le titrage 2 autres fois. La différence entre deux valeurs successives de HCl ne doit pas dépasser 0,05ml.
Travail à réaliser
1. Ecrire la réaction chimique qui se produit lors de ce titrage.
2. Calculer la normalité, la molarité et la concentration pondérale de NaOH.
3. Définir les indicateurs colorés. Peut-on utiliser un autre indicateur pour cette réaction?
4. Pourquoi avoir arrêter le titrage à la disparition de la couleur rose?
5. L’acide chlorohydrique est commercialisé en solution à 36%. Sachant que la densité de cette solution est d= 1,19 et que la masse molaire de HCl est 36,46 g.mol-1, quel volume de cette solution faut-il prélever pour préparer 2 litres de solution d’acide chlorohydrique à 4.10-2 mol.l-1.
Questions/Réponses
Exercices avec solutions (voir N°38 la réaction acide-base) http://mendeleiev.cyberscol.qc.ca/chimisterie/chimie534/titre.htm
http://www.lyc-international.ac-versailles.fr/IMG/pdf/TPChi7-corrige-1S1.pdf
http://www.lyc-international.ac-versailles.fr/IMG/pdf/_TPChi10-corrige-1S1.pdf
http://www.cpge-brizeux.fr/casiers/Emilie/2010-2011/tp/TP_Info_PC_AB_Corrige.pdf http://wonders-of-nature.jimdo.com/stav-chimie/acides-bases/
