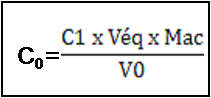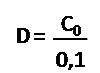- Le Lait
Un lait frais ne contient pas d'acide lactique (voir formule ci-contre). En vieillissant, le lactose présent dans le lait se transforme lentement en acide lactique sous l'action de bactéries. Ainsi moins un lait est frais, plus son acidité est grande. La mesure de l'acidité d'un lait permet d'évaluer sa fraîcheur. Si l'acidité du lait est trop importante, les protéines du lait précipitent: le lait "caille".
· Un lait est caractérisé par son degré Dornic : un degré Dornic, 1 °D, correspond à 0,10 g d'acide lactique par litre de lait (même si l'acide lactique n'est pas le seul acide présent).
· Pour être considéré comme frais, un lait doit avoir un degré Dornic inférieur ou égal à 18 °D.
- But du TP
L’Objectif est de titrer l'acide lactique contenu dans un lait afin de déterminer sa fraicheur en mesurant son degré Dornic.
- Calcul de l’acidité du lait : état de fraicheur
Nous allons déterminer le degré Dornic (D°) où 1 degré Dornic D° correspond à 0,1g d’acide lactique par litre de lait, même si l’acide lactique n’est pas le seul acide présent.
Pour cela, il faut calculer la concentration massique C0 en g/l ; c'est-à-dire la masse d’acide lactique contenu dans un litre de lait. Pour calculer cette concentration C0, on utilise la formule suivante : Où C1 est la concentration d’hydroxyde de sodium (soude) : C1 = 0.05 mol/l
Véq le volume équivalent, en ml, d’hydroxyde de sodium déterminé précédemment
Mac est la masse molaire de la molécule d’acide lactique.
V0 est le volume du lait : V0 = 20ml Calcul du degré Dornic D : par la formule suivante:
- Mode opératoire :
- Prendre 10ml du lait déjà dilué à 20%.
- Ajouter 3 gouttes de phénolphtaléine.
- Remplir la burette de solution d’hydroxyde de sodium de concentration molaire C1 = 0,025 mol/L. ajuster le niveau du liquide au niveau zéro de la burette.
- Placer, alors, l’erlenmeyer sous la burette.
- Agiter afin d’homogénéiser le mélange lait+phénolphtaléine.
- Verser à la burette de l’hydroxyde de sodium dans l’erlenmeyer jusqu’au virage au rose persistant.
- Remplir le tableau suivant au fur et à mesure :
- Questions :
- Ecrire la réaction de dosage de l’acide lactique.
- Indiquer entre quelles valeurs le volume d’hydroxyde de sodium Véq se trouve et calculer le.
- Calculer la concentration massique C0 en g/l
- Calculer le degré Dornic D.
- Indiquer par une croix la position du lait testé sur l’échelle proposée :
EXERCICES
http://www.lemonde.fr/revision-du-bac/annales-bac/chimie-terminale-s/detartrant-a-base-d-acide-lactique_t-crde87.html