- But du TP
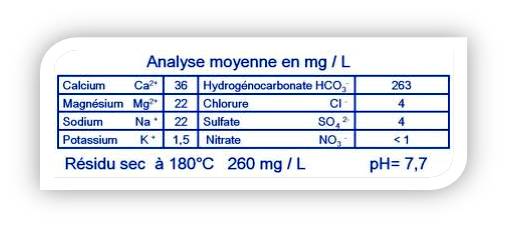
L’objectif de la manipulation proposée est la caractérisation de quelques ions contenus dans une eau minérale, après la réalisation des tests caractéristiques de quelques ions, on précède à la mise en évidence de quelques ions présents dans une eau minérale et on fait la comparaison des résultats trouvés aux indications portées sur l’étiquette.
- Principe du TP
Pour détecter certains ions en solution aqueuse on réalise des tests. Certains ions positifs et négatifs sont dits incompatibles et forment ensemble un précipité (solide) qui apparaît en solution si on y introduit l'autre ion non compatible du "couple". La couleur du précipité permet d'identifier l'ion présent dans l'eau.
- Mode opératoire
Après la réalisation du test ne pas jeter le contenu du tube, il servira de témoin pour la deuxième partie.
1) Test d’identification des ions argent Ag+ ou des ions chlorure Cl–
Dans un tube à essai, verser environ 1mL de chlorure de sodium. Ajouter ensuite quelques gouttes d'une solution de nitrate d'argent.
Il se forme un précipité blanc de chlorure d’argent AgCl (s). Le précipité noircit à la lumière
Ce test permet de caractériser aussi bien les ions argent que les ions de chlorure.
| |
| | | Ag + (aq) + Cl – (aq) → AgCl (s) | |
2) Test d’identification des ions fer III Fe3+
Dans un tube à essai, verser environ 1mL de solution de nitrate de fer III FeNO3- Ajouter ensuite quelques gouttes d'une solution de cyanure de potassium concentré KCN.
Il se forme un précipité rouille d’hydroxyde de fer III Fe(CN)3 (s).
Ce test permet de caractériser l’ion fer III Fe3+ | |
| | | Fe3+ (aq) + 3 NO-(aq) → Fe(NO)3 (s)
| |
3) Test d’identification Des ions Ca+2
Dans un tube à essai, verser environ 1mL de solution de chlorure de calcium. Ajouter ensuite quelques gouttes d'une solution d’oxalate de sodium
Il se forme un précipité blanc d’oxalate de calcium Ca(C2O4) (s).
Ce test permet de caractériser l’ion calcium Ca2+.
| |
| | | Ca2+ (aq) + C2O42– (aq) → Ca(C2O4) (s)
| |
4) Test d’identification des ions sulfate SO4-2
Dans un tube à essai, verser environ 1mL de solution de sulfate de sodium. Ajouter ensuite quelques gouttes d'une solution de chlorure de baryum.
Il se forme un précipité blanc de sulfate de baryum BaSO4(s).
Ce test permet de caractériser les ions sulfate SO4-2
| |
| | | Ba 2+ (aq) + SO4 2– (aq) → BaSO4 (s)
| |

De pluie, de mer, gazeuse ou plate, elle donne la vie et coupe la soif.
L'eau : n'en perdez pas une goutte !