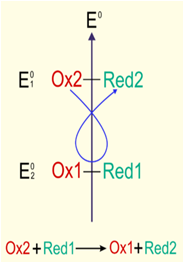
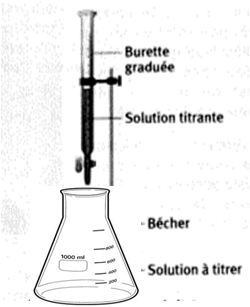
Questions/Réponses
Liens Externes
http://wonders-of-nature.jimdo.com/stav-chimie/oxydo-reduction/
http://www.enfa.fr/physique-chimie/wp-content/uploads/2009/10/dosage-par-manganimetrie.pdf
http://mbristiel.dyndns.org/~sph/documents/tstl/b/tp_2006-2007-chimie_14.pdf
http://www.rava-reny.com/
http://
http://www.discip.ac-caen.fr/
http://
Vidéos sur ce sujet
http://www.webtv.univ-montp2.fr/7794/tp-chimie-reaction-doxydoreduction-en-solution-acqueuse/
https://www.youtube.com/watch?v=rRlC16lUaCs&feature=player_detailpage
https://www.youtube.com/watch?v=YirvNL6cgeU&feature=related