-
Introduction
La dureté totale d’une eau est définie par la quantité d’ions calcium Ca+2 (dureté calcique) et magnésium Mg+2 (dureté magnésienne) présents dans cette eau. Elle s’exprime en °TH (degré hydrotimétrique). Les eaux courantes sont caractérisées par des degrés hydrotimétriques français échelonnés entre 0 et 50.
Certaines eaux minérales possèdent une forte teneur en ions de calcium et de magnésium, ce qui est au contraire recherché car ces ions confèrent à l’eau des propriétés diététiques.
-
1°TH = 1x10-4mol.L-1 ([Ca2+] + [Mg2+])
-
Un degré français équivaut aussi à 4mg de calcium par litre et à 2,4 mg de magnésium par litre.
-
Une forte dureté de l’eau est responsable de la détérioration de la robinetterie et rend difficile l’utilisation et le rinçage des détergents.
On utilise la classification suivante :
-
But du TP
Le but de ce TP est de déterminer la dureté calcique et totale d’une eau de distribution.
III. Principe des dosages
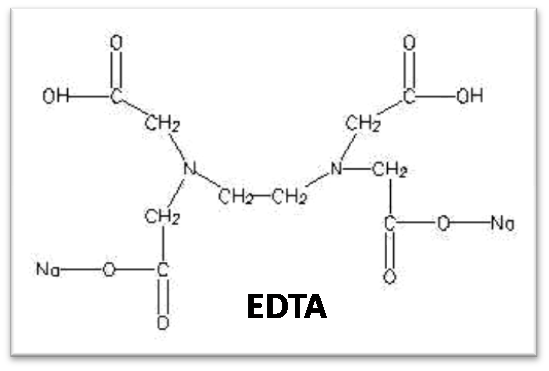
Pour déterminer la concentration en ions calcium et en ions magnésium dans une eau on utilise une réaction de complexation avec l’ion éthylènediaminetétraacétate EDTA un tétracide que l’on note Y4- sa formule :
Ca+2aq+Y4-(aq) = [CaY]_2
Mg+2 (aq) + Y4- (aq) = [MgY]2-
Le dosage s’effectue à partir du sel disodique de l’EDTA Na2H2Y en milieu tamponné à pH 10, le pH auquel on observe de bons résultats expérimentaux.
Les complexes de l’EDTA avec les ions Ca+2 et Mg+2 ne sont pas colorés. Afin de détecter l’équivalence, on complexe les ions Ca2+ et Mg+2 contenus dans l’eau minérale par le noir d’ériochrome NET, donnant des complexes colorés mais moins stables qu’avec l’EDTA. Lors de l’ajout de la solution titrante d’EDTA, le NET est progressivement libéré jusqu’à l’équivalence où il est libre en solution.
Le NET joue le rôle d’indicateur de fin de réaction. Il est violet en présence d’ions Ca et Mg, et bleu dans l’eau distillée.
IV. Mode opératoire
Il est impératif d’introduire les composés dans l’ordre indiqué :
-
Introduire V0 = 10 mL d’eau du robinet dans un bécher
-
Ajouter environ 5 mL de tampon ammoniacal pH= 10.
-
Ajouter quelques gouttes de NET.
-
Puis doser cette prise d’essai à l’aide de la solution d’EDTA placée dans la burette jusqu’au virage de la solution du rouge au bleu.
-
Réaliser un dosage rapide puis un dosage précis.
V. QUESTIONS
-
Déduire la relation à l’équivalence entre le nombre de moles de Ca+2 et Mg+2 et le nombre de moles d’EDTA.
-
Calculer le degré hydrotimétrique de l’eau
-
Calculer les valeurs en mg/l des concentrations massiques des ions Ca+2 et Mg+2.
-
Qualifier la dureté de cette eau (dire si elle est dure ou douce.)
EXERCICES
http://www.lemonde.fr/revision-du-bac/annales-bac/chimie-terminale-s/une-carafe-filtrante-permet-elle-de-diminuer-la-durete-d-une-eau_t-crde70.html